在生物學(xué)里��,核酸分子承擔(dān)遺傳信息載體的功能���。另外,由于核酸分子信息量大�����、易化學(xué)合成��、易信號(hào)標(biāo)記�����、可編碼屬性�����、良好的識(shí)別能力以及明確的結(jié)構(gòu)參數(shù)���,它在探針構(gòu)建��、材料制備���、醫(yī)學(xué)診療等多個(gè)領(lǐng)域展現(xiàn)出了優(yōu)異的性能,具有高的科學(xué)研究?jī)r(jià)值和應(yīng)用潛力���,吸引了廣泛的研究興趣����。其中����,核酸分子包含豐富的功能位點(diǎn)(-P,-OH, -N, -O等)��、納米幾何結(jié)構(gòu)及獨(dú)特的構(gòu)型,為它與其它物質(zhì)的相互作用提供了有效作用位點(diǎn)�����。尤其核酸-金屬相互作用種類豐富��、機(jī)理各異���,在作用機(jī)理闡釋和探針應(yīng)用方面還存在諸多調(diào)整����。近年來(lái)�,長(zhǎng)沙理工大學(xué)化學(xué)與食品工程學(xué)院卿志和博士課題組圍繞“核酸-金屬化學(xué)及探針構(gòu)建”這一主題,針對(duì)其中的具體科學(xué)問(wèn)題開(kāi)展了較為系統(tǒng)的研究���,并取得了階段性新進(jìn)展����,近期在國(guó)際化學(xué)頂刊《德國(guó)應(yīng)用化學(xué)》連續(xù)發(fā)表論文兩篇���。
首先���,基于DNA探針在鉑納米顆粒表面的高穩(wěn)定性修飾和高保真信號(hào)釋放的前期研究基礎(chǔ)(Zhihe Qing, et al. Angew. Chem. Int. Ed. 2020, 59, 14044-14048; Zhihe Qing, et al. CCS Chem. 2020, 2, 1217–1230),卿志和博士課題組發(fā)展了一種細(xì)菌感染激活的納米酶��,在生理?xiàng)l件下同時(shí)打破局部pH和過(guò)氧化氫的限制����,提高慢性傷口部位的抗菌效果。選取糖尿病傷口感染為研究模型�����,以DNA分子(細(xì)菌特異性核酸適體)功能化的鉑納米酶���、葡萄糖氧化酶和透明質(zhì)酸為組裝單元�,構(gòu)建透明質(zhì)酸酶(HAase)激活的納米酶膠囊(APGH)�。APGH在受感染的傷口中被細(xì)菌分泌的透明質(zhì)酸酶激活,之后納米酶通過(guò)表面修飾的核酸適體與細(xì)菌結(jié)合�����,葡萄糖氧化酶催化糖尿病傷口中高濃度的葡萄糖氧化�,降低pH,補(bǔ)充過(guò)氧化氫���,鉑納米酶在細(xì)菌表面原位生成·OH���,提高了化動(dòng)力學(xué)殺菌效果�。APGH的活性轉(zhuǎn)化與抗菌作用在體外實(shí)驗(yàn)和糖尿病傷口抗菌實(shí)驗(yàn)中得以驗(yàn)證�。這種通過(guò)調(diào)控生理微環(huán)境以增強(qiáng)納米酶活性的策略具有通用性,對(duì)促進(jìn)納米酶的生物學(xué)應(yīng)用具有重要意義(Scheme 1)��。該工作以“A Glucose-Powered Activatable Nanozyme Breaking pH and H2O2 Limitations for Treating Diabetic Infections”為題�,于2021年8月10日發(fā)表在國(guó)際化學(xué)領(lǐng)域頂刊Angewandte Chemie,并入選VIP論文(Very Important Paper)和封面成果(Frontispiece)�����,并被期刊官媒作新聞(News)報(bào)道�。文章共同第一作者是長(zhǎng)沙理工大學(xué)碩士生陳麗芳、碩士生邢碩暉和雷艷麗博士�,通訊作者是卿志和副教授和楊榮華教授。文章鏈接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202107712���。

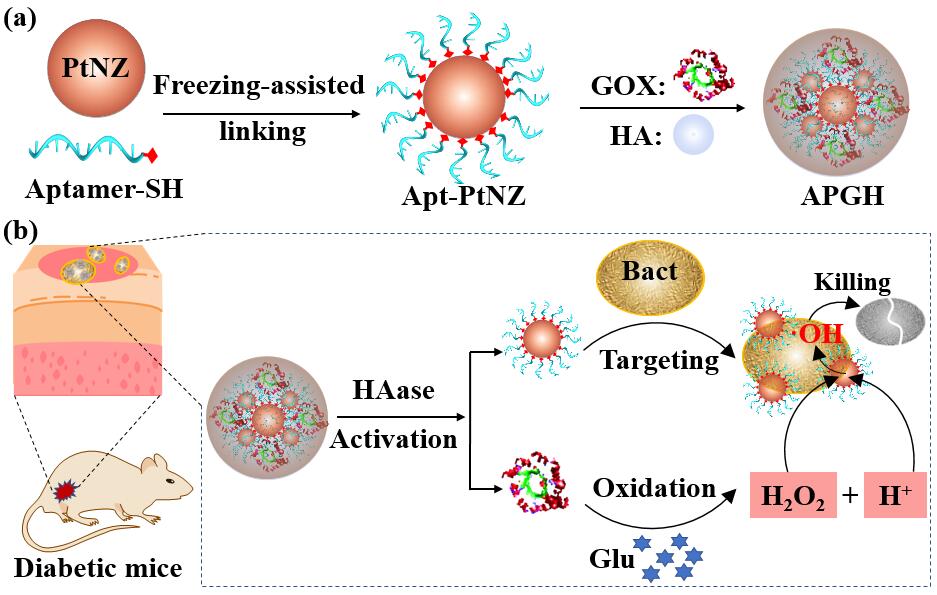
Scheme 1. (a) The preparation route for the nanozyme capsule (APGH) with aptamer-functionalized platinum nanozymes (Apt-PtNZ), glucose oxidase (GOX) and hyaluronic acid (HA). (b) Schematic illustration of APGH activation, activity switching in the infected wound, and its application for chemodynamic sterilization through in situ generation of ·OH on bacteria surface.
隨后�,基于核酸編碼金屬納米材料的研究基礎(chǔ)(Zhihe Qing, et al. Nano Today 2021, 36, 101021-101042; Zhihe Qing, et al. Angew. Chem. Int. Ed. 2013, 52, 9719-9722)���,卿志和博士課題組發(fā)展了一種Zn2+配位驅(qū)動(dòng)的RNA納米組裝方法�����,實(shí)現(xiàn)功能RNA分子(mRNA����、miRNA等)的細(xì)胞內(nèi)高效遞送����。該方法操作簡(jiǎn)單,只需要將RNA分子和Zn2+在95℃下混合�����,即可獲得具有球形形貌的納米顆粒�。由于高溫消除了RNA復(fù)雜的二級(jí)結(jié)構(gòu),因此����,該方法適用于不同組成、長(zhǎng)度(從20到近1000個(gè)核苷酸)和結(jié)構(gòu)的功能性RNA的包載�����,突顯了其普適性�����。此外,相較于脂質(zhì)體����、陽(yáng)離子聚合物、無(wú)機(jī)納米載體等常用的RNA納米載體�,Zn2+配位驅(qū)動(dòng)組裝的RNA納米顆粒具有優(yōu)異的RNA包載量和轉(zhuǎn)染效率。更重要的是���,凝膠電泳���、熒光光譜和ESI質(zhì)譜等結(jié)果表明,包載的RNA保持了其結(jié)構(gòu)的完整性����;通過(guò)考察合成的綠色熒光蛋白基因mRNA納米顆粒和抑癌miRNA納米顆粒的生物學(xué)性能,發(fā)現(xiàn)Zn2+配位驅(qū)動(dòng)的納米組裝體能夠維持包載RNA的生物學(xué)功能��,發(fā)揮高效的熒光信號(hào)報(bào)告作用和抗腫瘤作用(Scheme 2)�。該工作以“Zn2+-Coordination-Driven RNA Assembly with Retained Integrity and Biological Functions”為題,于2021年8月17日發(fā)表在國(guó)際化學(xué)領(lǐng)域頂刊Angewandte Chemie����,并被中國(guó)科學(xué)網(wǎng)和德國(guó)Willey數(shù)據(jù)庫(kù)公眾號(hào)(WilleyChem)采訪報(bào)道�����。文章共同第一作者是鄒振博士和碩士生賀麗蓓��,通訊作者是卿志和副教授和楊榮華教授���。文章鏈接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202110404���。


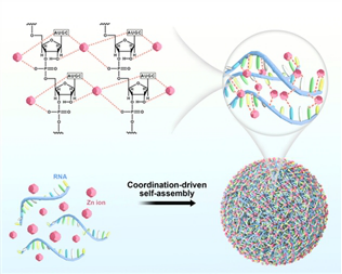
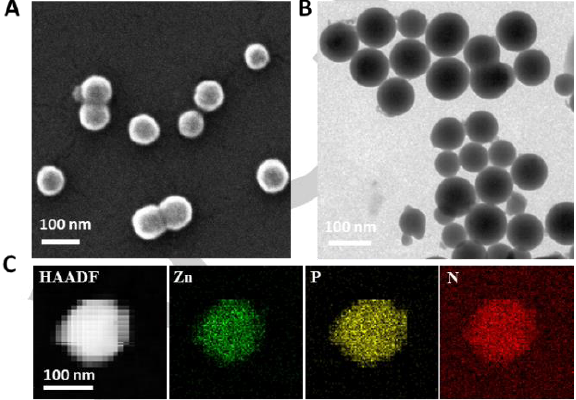
Scheme 2. Left: Schematic illustration of Zn2+-driven self-assembly of Zn2+ and RNA molecules. Right: (A) SEM image and (B) TEM image of the Zn-RNA NPs. (C) High angle annular dark field-scanning transmission electron microscopy (HAADFSTEM) image and the corresponding elemental mapping images of the Zn-RNA NPs.
附:課題組近年取得的代表性成果(10篇):
[1] Lifang Chen, Shuohui Xing, Zhihe Qing*, et al. Angew. Chem. Int. Ed. 2021, DOI: 10.1002/anie.202107712.
[2] Zhen Zou, Libei He, Zhihe Qing*, et al. Angew. Chem. Int. Ed. 2021, DOI: 10.1002/ange.202110404.
[3] Fengzhou Xu, Taiping Qing, Zhihe Qing*. Nano Today 2021, 36, 101021-101042.
[4] Zhihe Qing*, Jinlei Hu, Jingyuan Xu, et al. Chem. Sci. 2020, 11, 1985-1990.
[5] Zhihe Qing*, Jingyuan Xu, Jinlei Hu, et al. Angew. Chem. Int. Ed. 2019, 58, 11574-11585.
[6] Zhihe Qing, Guoyan Luo, Shuohui Xing, et al. Angew. Chem. Int. Ed. 2020, 59, 14044-14048.
[7] Zhihe Qing*, Ailing Bai, Lifang Chen, et al. CCS Chem. 2020, 2, 1217-1230.
[8] Zhihe Qing, Xiaoxiao He, Dinggeng He, et al. Angew. Chem. Int. Ed. 2013, 52, 9719 -9722.
[9] Zhihe Qing*, Lixuan Zhu, Xiaoxuan Li, et al. Environ. Sci. Technol. 2017, 51, 11884-11890.
[10] Changhui Liu, Weiju Chen, Zhihe Qing*, et al. Anal. Chem. 2016, 88, 3998-4003.
(圖文/卿志和 審/曹忠)

